Contenuto
- Miscela di acidi
- Passo 1
- Passo 2
- Passaggio 3
- Passaggio 4
- Passaggio 5
- Miscela di base
- Passo 1
- Passo 2
- Passaggio 3
- Passaggio 4
- Passaggio 5
- Passaggio 6

Sai come calcolare il pH di un acido in una soluzione o di una base in una soluzione, ma calcolare il pH di due acidi o due basi è un po 'più difficile. Utilizzando la formula descritta di seguito, è possibile stimare il pH di una miscela monoprotica tra due di tali sostanze chimiche. Questa equazione ignora l'autoionizzazione dell'acqua, poiché il suo valore non genera in ogni caso un cambiamento importante del pH.
Miscela di acidi
Passo 1
Fare clic sul collegamento nelle fonti di quell'articolo per ottenere la tabella con le costanti di dissociazione (valori pKa) per diversi acidi comuni. Nota i valori pKa per i due acidi che stai utilizzando.
Passo 2
Converti i valori pKa in valori Ka utilizzando la seguente equazione: Ka = 10 ^ -pKa, quindi se pKa è 5, Ka = 10 ^ -5.
Passaggio 3
Nota la seguente formula: [H +] ^ 2 = Ka1 [A1] + Ka2 [A2], dove [H +] è la concentrazione di ioni idrogeno e A1 e A2 sono le concentrazioni degli acidi che stai usando. Ricorda che in chimica, parentesi come [] indicano le concentrazioni.
Passaggio 4
Immettere le concentrazioni dei propri acidi e i loro valori Ka, quindi calcolare [H +]. Ad esempio, supponiamo che l'acido 1 abbia un Ka di 1 x 10 ^ -4, mentre l'acido 2 abbia un Ka di 3 x 10 ^ -4 e che entrambi siano presenti in una concentrazione di 1 mol. La tua equazione avrà questo aspetto: [H +] ^ 2 = 1 x 10 ^ -5 [1] + 3 x 10 ^ -4 [1] [H +] ^ 2 = 1 x 10 ^ -5 + 3 x 10 ^ -4 [ H +] ^ 2 = 3,1 x 10 ^ -4 [H +] = 0,018
Passaggio 5
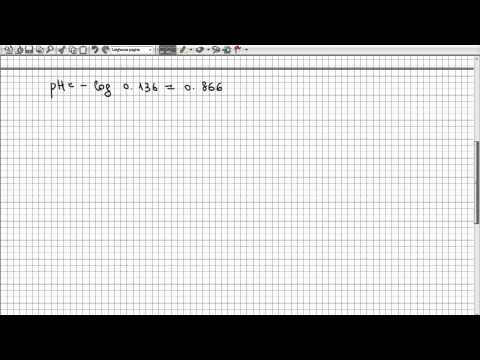
Calcola il logaritmo del valore appena trovato sulla calcolatrice, quindi rendilo negativo. Il log di una concentrazione [H +] è il pH. Ad esempio: log 0,018 = -1,75, quindi pH = 1,75.
Miscela di base
Passo 1
Fare clic sul collegamento nelle fonti di quell'articolo per ottenere una tabella delle costanti di disaccoppiamento (valori pKb) per diverse basi comuni. Scrivi i valori pKb per le due basi che stai utilizzando.
Passo 2
Converti i valori pKb in valori Kb utilizzando la seguente equazione: Kb = 10 ^ -pKb, quindi se pKb è 5, Kb = 10 ^ -5.
Passaggio 3
Scrivi la seguente formula: [OH -] ^ 2 = Kb1 [B1] + Kb2 [B2], dove [OH-] è la concentrazione di ioni idrossido e B1 e B2 sono le concentrazioni delle basi che stai usando.
Passaggio 4
Immettere le concentrazioni di base e i valori Kb, quindi calcolare [OH-]. Ad esempio, supponiamo che la base 1 abbia 1 x 10 ^ -4 Kb, mentre la base 2 abbia 3 x 10 ^ -4 Kb ed entrambe siano presenti in concentrazione di 1 mol. La tua equazione sarà: [OH -] ^ 2 = 1 x 10 ^ -5 [1] + 3 x 10 ^ -4 [1] [OH -] ^ 2 = 1 x 10 ^ -5 + 3 x 10 ^ -4 [OH-] ^ 2 = 3,1 x 10 ^ -4 [OH-] = 0,018
Passaggio 5
Calcola il log del valore che hai trovato sulla calcolatrice e rendilo negativo. Il log di una concentrazione di [OH-] è pOH. Ad esempio, log 0,018 = -1,75, quindi pOH = 1,75.
Passaggio 6
Sottrai il pOH da 14 per ottenere il pH. Ad esempio, 14,0 - 1,75 = pH = 12,3.