Contenuto

La titolazione è una procedura che determina la concentrazione di un liquido, tipicamente un acido o una base. Durante la titolazione, la sostanza di concentrazione nota viene aggiunta a quella di cui non si conosce la concentrazione, fino a quando il numero di molecole reagenti non è uguale. Poiché il pH cambia durante una titolazione acido-base, è possibile rappresentare graficamente la variazione di pH in relazione alla quantità "nota" aggiunta. Da questo grafico è possibile calcolare il Ka, che è la costante di dissociazione dell'acido. PKa è il logaritmo negativo di Ka ed è un modo più conveniente per esprimere questa costante, poiché Ka è solitamente molto piccolo.
Passo 1
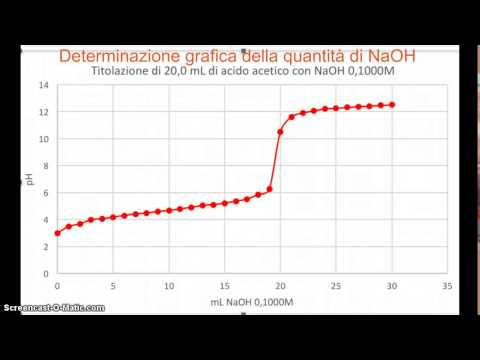
Traccia i dati di titolazione su un grafico, su carta o in Excel. Il pH deve essere l'asse ye il titolante (reagente di concentrazione nota) deve essere sull'asse x. Se il grafico viene eseguito manualmente, cerca di essere il più accurato possibile. Collega i punti per ottenere una curva a S invece di creare linee più adatte.
Passo 2
Trova il punto di equivalenza, il pH al quale il numero di molecole reattive di acido e base è esattamente lo stesso. Probabilmente durante la titolazione è stato utilizzato un indicatore colorato e questa informazione è già stata ottenuta. Il punto di equivalenza è anche il punto più ripido sulla curva di titolazione.
Passaggio 3
Determina il pKa come valore di pH equivalente alla metà del punto di equivalenza. È possibile giustificare questo valore perché al centro di questo punto le concentrazioni di sostanze protonate e deprotonate, sconosciute, sono tra loro equivalenti. L'espressione di equilibrio per la concentrazione sconosciuta sarebbe Ka = [unknown -]. [H3O ++] / [unknown H] e, poiché la concentrazione di H sconosciuta è uguale a [unknown-], questa equazione può essere riscritta come Ka = [ H3O +]. Prendi il logaritmo da entrambi i lati, moltiplicali per -1 e l'equazione diventa pKa = pH.