![Strutture di Lewis • Ione Clorito [ClO2]-](https://i.ytimg.com/vi/EshsdChLFXI/hqdefault.jpg)
Contenuto
- Numero di elettroni nel guscio di valenza
- Passo 1
- Passo 2
- Passaggio 3
- Passaggio 4
- Struttura di Lewis
- Passo 1
- Passo 2
- Passaggio 3
- Carica formale di ogni atomo
- Passo 1
- Passo 2
- Passaggio 3
Quando si determina la carica formale di una molecola come CoCl2 (gas fosgene), è necessario conoscere il numero di elettroni nello strato di valenza di ciascun atomo e la struttura di Lewis della molecola.
Numero di elettroni nel guscio di valenza
Passo 1
Cerca ogni atomo nella tavola periodica degli elementi per determinare il numero di elettroni nel guscio di valenza.
Passo 2
Ricorda che due elettroni sono al primo sottolivello s, due al secondo sottolivello s, sei elettroni al primo sottolivello p, ecc. Ricorda: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6).
Passaggio 3
Colpisci il carico. Se la molecola è uno ione, aggiungi o sottrai uno o più elettroni dal totale per arrivare alla carica finale.
Passaggio 4
Per CoCl2 (gas fosgene): C = 4; O = 6; Cl = 7. La molecola non è ionizzata e ha una carica neutra. Pertanto, il numero totale di elettroni nel guscio di valenza è 4 + 6 + (7x2) = 24.
Struttura di Lewis
Passo 1
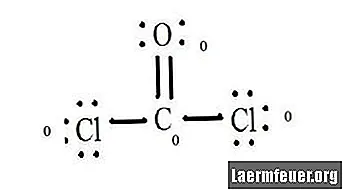
Vedi il diagramma della struttura di Lewis di CoCl2 (gas fosgene). La struttura di Lewis rappresenta la struttura più stabile e probabile per la molecola. Gli atomi vengono trascinati con elettroni di valenza accoppiati; si formano legami tra elettroni liberi per soddisfare la regola dell'ottetto.
Passo 2

Disegna ogni atomo e i suoi elettroni di valenza e poi forma i legami secondo necessità.
Passaggio 3
Gli atomi di cloruro condividono legami semplici con la molecola di carbonio, mentre l'atomo di ossigeno forma un doppio legame con il carbonio. Ogni atomo nella struttura finale soddisfa la regola dell'ottetto e ha otto elettroni nel guscio di valenza, consentendo la stabilità molecolare.
Carica formale di ogni atomo
Passo 1
Contare le coppie prive di elettroni di ciascun atomo nella struttura di Lewis. Ad ogni atomo viene assegnato un elettrone da ogni legame a cui partecipa. Aggiungi quei numeri. In CoCl2: C = 0 coppie libere più 4 elettroni di legami = 4 elettroni. O = 4 elettroni di coppie libere più 2 elettroni di legami = 6 elettroni. Cl = 6 elettroni di coppie libere più un elettrone di un legame con C = 7 elettroni.
Passo 2
Sottrai la quantità del numero di elettroni nel guscio di valenza nell'atomo non legato. Il risultato è la carica formale per ogni atomo. In CoCl2: C = 4 elettroni di valenza (ev) nell'atomo non legato meno 4 elettroni designati nella struttura di Lewis (LS) = 0 carica formale O = 6 ev - 6 LS = 0 carica formale Cl = 7 ev - 7 LS = 0 carico formale
Passaggio 3
Quando scrivi, posiziona queste cariche vicino agli atomi nella struttura di Lewis. Se la molecola ha una carica in totale, metti la struttura di Lewis tra parentesi con la carica scritta all'esterno nell'angolo in alto a destra.